问题分类
热点问题
㓩常见问题 > 会员公告 > 会员新福利,乐享药智网—FDA器械上市前通知/批准数据库免费查
会员新福利,乐享药智网—FDA器械上市前通知/批准数据库免费查
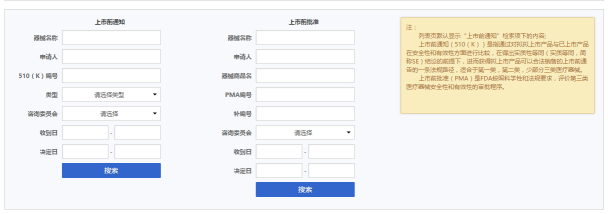
幸福的药智会员们,你们又有新福利了! 药智数据团队倾心打造的FDA器械上市前通知/批准数据库已上线,供药智网会员免费查询。点击图片查看新数据库↑↑↑FDA器械上市前通知/批准数据库介绍 FDA器械上市前通知/批准数据库收录了美国PremarketApproval(PMA)和510(k)PremarketNotification信息,可查询美国医疗器械注册申报的有关数据。 PMA是FDA按照科学性和法规要求,评价第三类医疗器械安全性和有效性的审批程序。 510(K)是指通过对拟上市产品与已上市产品在安全性和有效性方面进行比较,在得出实质性等同(SubstantialEquivalence,简称SE)结论的前提下,进而获得拟上市产品可以合法销售的上市前通告的一条法规路径,适合于第一类、第二类、少部分三类医疗器械。 数据库左侧查询510(k),右侧查询PMA。数据库列表页则默认510(k)的数据。本数据可通过器械名称、器械商品名、申请人、510K编号、PMA编号、补编号、类型、咨询委员会、收到日、决定日来进行数据查询。 数据每月更新,向药智网会员提供免费查询服务。 什么情况下,您会用到它? 1、医疗器械出口美国 医疗器械进入美国市场进行销售,必须通过510(K)或PMA的审核。通过该数据库,查询美国器械的上市情况,只有通过了510(K)或PMA才能在美国市场销售。 2、美国医疗器械采购(进口) 通过该数据库,可以了解到美国上市的医疗器械的情况,以便做出合理的器械采购计划和市场分析。 3、美国医疗器械注册/认证 通过查询该数据库的器械分类,了解相似器械的审批时长,审批结论等信息。 4、美国医疗器械市场分析 查询该数据库,了解美国医疗器械市场情况,对美国医疗器械市场的需求进行分析和预测。 点击此处体验FDA器械上市前通知/批准数据库! 欢迎加入QQ群(277567052),和我们的产品狗们亲密接触,我们会第一时间接受您的反馈。 药智网团队保证用最负责任的态度为您打造一流的医药数据产品。